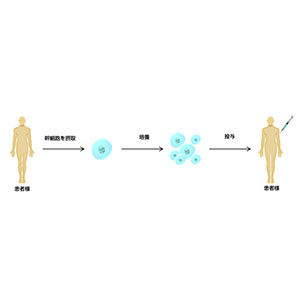
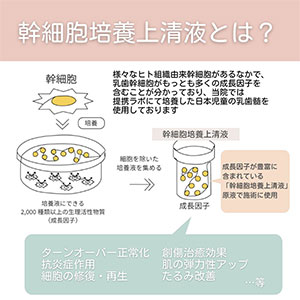
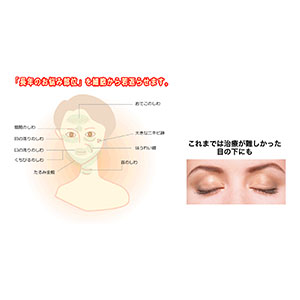
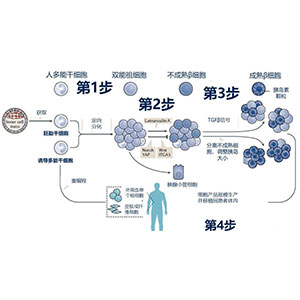
Avolve度他雄胺胶囊0.5mg: 30粒
9,000日元
日文名称 アボルブカプセル0.5mg【劇】30カプセル(10カプセル×3)PTP
制药公司 グラクソ・スミスクライン 株式会社(葛兰素史克GSK)
销售公司 グラクソ・スミスクライン 株式会社(葛兰素史克GSK)
产品编号 C-QLX001
产品详情



效果/功效(完整包装说明书)
前列腺肥大。
(与疗效或功效相关的注意事项)
尚未证实对无前列腺肥大患者的疗效和安全性。国内临床试验针对前列腺体积30 mL及以上的患者[见17.1.1和17.1.2]。
剂量和给药(完整包装说明书)
成人常用剂量为度他雄胺 0.5 毫克,每天口服一次。
(与剂量和给药有关的注意事项)
虽然在给药开始时可能会观察到改善,但通常需要治疗6个月才能评估治疗效果。
副作用(完整说明书)
可能会出现以下副作用,因此请仔细监测患者,如果发现任何异常,请采取停止给药等适当措施。
严重副作用:
肝功能障碍(1.5%)、黄疸(发生率不明):可能会出现肝功能障碍、黄疸并伴有 AST、ALT、胆红素等升高。
其他副作用
- 超敏反应:(低于1%)荨麻疹、(发生率未知)过敏反应、皮疹、瘙痒、局部水肿、血管性水肿。
- 神经精神系统:(1%以上)性欲下降、(低于1%)头晕、(发生率未知)情绪低落、味觉异常。
- 生殖系统和乳腺疾病:(1%以上)勃起功能障碍、乳腺疾病(男性乳房发育、乳头疼痛、乳腺痛、乳房不适)、(小于1%)射精障碍、(发生率不明)睾丸疼痛、睾丸肿胀。
- 皮肤:(发病率未知)脱发(主要是体毛脱落)、多毛症。
- 胃肠道:(低于1%)腹部不适,(发生率未知)腹泻。
- 其他:(低于1%)疲劳,(发生率未知)血液CK升高。
使用注意事项(完整说明书)
(禁忌症)
- 对本药成分和其他5α-还原酶抑制剂有过敏史的患者。
- 女性[参见第 8.1、9.5 孕妇、9.6 哺乳期妇女]。
- 儿童等 [参见第 8.1、9.7 节儿童等]。
- 严重肝功能障碍患者[见9.3.1]。
(重要基本说明)
- 由于该药物通过皮肤吸收,因此妇女和儿童不应接触从胶囊中泄漏的药物(如果接触到泄漏的药物,请立即用肥皂和水清洗)[2.2,2.3,9.5孕妇 – 9.7 参见有关儿童等的部分]。
- 在服用这种药物之前,应进行直肠检查和其他前列腺癌检查。此外,即使在服用这种药物的同时,也要定期进行直肠检查和其他前列腺癌检查。
- 本药会影响血清前列腺特异性抗原(PSA),因此请注意以下几点。
PSA值是前列腺癌筛查的重要指标。一般来说,如果PSA值高于参考值(通常为4.0 ng/mL),则需要进一步评估并考虑前列腺活检。此外,应注意,接受该药物的患者即使在用药前的PSA值低于参考值,也不能排除前列腺癌的诊断。
即使患有前列腺癌,服用 6 个月后,该药物也会使 PSA 水平降低约 50%。因此,在评估服用本药6个月或以上患者的PSA值时,将测量值加倍并与标准值比较。停药后6个月内PSA值恢复至开始用药前的值。
应仔细评估服用该药物期间 PSA 值的持续升高,同时考虑到前列腺癌的发生和不遵守该药物的情况。
由于游离/总 PSA 比率在该药物给药期间保持恒定,因此在使用 %游离 PSA 进行前列腺癌筛查时无需调整测量值。
(特定背景患者的注意事项)
(肝功能障碍患者)
严重肝功能障碍患者:不要给药(本药主要在肝脏代谢,因此血药浓度可能升高)[见2.4]。
肝功能障碍患者(不包括严重肝功能障碍):本药主要在肝脏代谢。尚未对肝功能不全患者给药时的药代动力学进行研究[见16.4.1]。
(孕妇)
女性请勿服用(大鼠和兔子口服度他雄胺后,观察到男性胎儿的外生殖器女性化,接触该药物导致血液二氢睾酮下降,导致外生殖器发育)男性胎儿的生殖器官(见2.2、8.1)。
(哺乳期妇女)
请勿给女性服用。目前尚不清楚该药物是否会进入母乳[见2.2,8.1]。
(儿童等)
请勿给儿童等服用。(本品不适合儿童等使用,尚未进行针对儿童等的有效性和安全性的临床试验。) [参见2.3、8.1] 。
(相互作用)
该药主要由CYP3A4代谢[见16.4.1]。
并用注意事项:
抑制CYP3A4的药物(利托那韦等)[见16.7.1][与这些药物同时使用可能会增加本药的血药浓度(CYP3A4对本药的代谢可能受到抑制)] 。
(应用笔记)
- 发放药品时的注意事项 嘱患者将PTP包装的药品从PTP片中取出后再服用(若不慎吞服PTP片,坚硬、锋利的边缘可能会刺破食管粘膜,甚至穿孔,导致纵隔鼻窦炎等严重并发症。可能会出现症状)。
- 服用胶囊时不应咀嚼或打开,因为胶囊内容物可能会刺激口咽粘膜。
(其他说明)
- 基于临床使用的信息
在一项海外临床试验中,18岁至52岁的健康成年人(药物组27名患者,安慰剂组23名患者)在52周的治疗期间和给药后24周内服用0.5 mg该药物随访期间。给药后52周时,精子总数、精液量和精子活力较给药前值的平均下降率(根据安慰剂组给药前值的变化进行调整)有精子总数减少23%,精液量减少26%,精子活力减少18%。未观察到对精子浓度或精子形态的影响,该药物组的精子总数平均减少24周的随访期后,该比率仍保持在23%,然而,在两个评估时间,所有精液参数的平均值均在正常范围内,并且在预先指定的临床范围内。没有达到重要的水平(30%)(另外,在药物组的两名患者中,在给药52周时观察到精子数量比给药前值减少了90%以上,但在给药24周时观察到精子数量比给药前值减少了90%以上。后续,松了口气)。目前尚不清楚该药物对精液特征的影响对个体患者的生育能力有何临床意义。
上市后,已有接受该药物治疗的患者出现男性乳腺癌的报道。度他雄胺与男性乳腺癌发生之间的关系尚不清楚。此外,海外历时2至4年的临床试验(4325例)报告了3例乳腺癌病例。其中,报告了 2 例服用度他雄胺的病例(暴露期 10 周、11 个月),报告了 1 例仅服用安慰剂的病例。国内临床试验尚未见报道。
在一项为期 4 年的国际联合研究(包括 57 名日本患者)中,研究对象为 8,231 名年龄在 50 至 75 岁之间的白人男性(前列腺癌活检呈阴性且 PSA 水平为 2.5 至 10.0 ng/mL)。*报告称,前列腺癌的发病率与a 修正格里森评分为 8 至 10,该药物组 (1.0%) 高于安慰剂组 (0.5%)(相对风险 2.06 [95% 置信区间:1.13-3.75])。
*) 组织学恶性肿瘤指标。 - 基于非临床研究的信息
由于在器官形成期向恒河猴静脉注射度他雄胺高达 2010 ng/动物/天,2010 ng/动物/天组(假设服用该药物的男性通过 5 mL 精液 100% 吸收)虽然目前尚不清楚这种关系是否与服用该药物有关,一名女性病例(相当于体重 50 公斤的女性估计最大暴露剂量的 186 倍)报告胎儿卵巢发育不平衡和胎儿输卵管发育不平衡。认可。
在一项大鼠致癌性研究中,当给予高剂量(大约是临床剂量的 141 倍)时,观察到睾丸间细胞肿瘤的增加。然而,人类患睾丸间细胞癌的风险被认为较低,因为将睾丸细胞癌和增生引起的大鼠内分泌机制外推到人类的风险较低。此外,在小鼠致癌性试验中,没有观察到被认为与度他雄胺有关的肿瘤。
(操作注意事项)
储存在 PTP 包装中,避免暴露在光线和潮湿的环境中。
(保险福利注释)
这种制剂的功效或作用是“良性前列腺增生”。
如果该产品用于治疗“男性雄激素性脱发”,则不属于保险承保范围。
(保存注意事项)
室温保存。
【免责声明】
我们在网站上显示最新的产品信息,但产品规格・样式(容量、包装、原材料、原产国等)可能会因制造商的情况而变更。因此,实际交付的产品资讯可能与网站上的产品资讯有所不同,因此请务必在使用前查看交付产品的产品标签和注意事项。